物理/化学部「原子量」をくわしく解説!
「原子そのものに重いものや軽いものがあるから物質の密度もさまざまである。」というのは一応は正しい。とくに気体の場合には、気圧と温度とを定めてやれば、同じ体積の中にはほぼ同じ個数の分子があるから、気体の密度は分子量に比例している。
ところが固体では、必ずしもそうはなっていない。アルミニウムの原子量 26.98153986 の 10 分の 1 がほぼ実測値の密度( g・cm-3)の値に等しいから、よく知られた金属の原子量 の 10 分の 1 と密度とを比較してみよう(いずれも室温、水銀のみは液体で、 0 ℃ )。
結晶系としては、最も標準になるものに、単純立方 (簡単に sc と書く )、体心立方(bcc )、面心立方 (fcc)などがあるが、表に挙げた金属は、固体では鉄以外はすべて面心立方形であり、みな同じような形態をしている。鉄は 960 ℃ までが対心立方(これをアルファ鉄という )、 960 ~ 1401 ℃ が面心立方(ガンマ鉄 )、それ以上 1535 ℃ の融点までは再び体心立方になりデルタ鉄とよぶ。
|
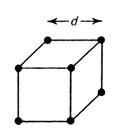
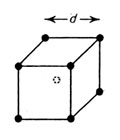
d :格子定数
|
||
 |
 |
|
|
単純立方
sc |
体心立方
bcc |
面心立方
fcc |
結晶型が同じでありながら、密度が原子量に比例しないのは、結晶の立方体の一辺の長さ( これを格子定数とよぶ)が違うことが最も大きな原因である。そのほかには格子欠陥 (格子点がカラになっているような状態)なども考えられるが、とにかく原子量だけでは必ずしも密度が推定できない。
鉛は重いというのが一般通念だが、確かにその原子は重い。しかし密度は金や白金と比べて、かなり小さい。つまり結晶の中の原子間隔は他の金属と比べて長い、と推論される。水銀原子は重いが、密度がそれほどには大きくないのは、これは液体状になっており、並び方が不揃いで、隙間が大きいためと考えるのが当を得ている。鉄や銅は、原子量から計算される値よりも密度が大きいのは、原子間隔が短いせいだろう。白金塊を手にすることはほとんどないが、金地金などは、小さいながらも意外と重いというのが初めて持った人の感想である。
【理科年表編集委員会(2006年11月)】




