物理 / 化学部「溶液の密度 液体の分子論的機構」をくわしく解説!
液体の密度を理論的に、つまり分子あるいは原子の集合体としてその模型を頼りに推定するのは難しい。液体分子は狭い範囲 (分子で数個程度)では固体と同じようにほぼ規則的な配列をしているが、少し離れた分子の間には、もはや並び方の規則性はない。こんなとき、短距離秩序はあるが、長距離秩序はないという。この意味で液体では、密度の実験値を求めて、これからどの程度密に (あるいは規則的に)詰まっているかを推定することになる。
純粋液体では、水銀と水の密度の温度依存性が挙げられている。水溶液密度の濃度依存をみよう。
われわれの身近にある液体は、無機物の水銀と有機物の石油 (CmHn ) と、アルコール、エーテルなどの特別なものを除けば、そのほとんどは水または溶液である。果汁 100 % といっても、実際には大部分が水であることはよく知られている。それどころか人間の身体さえも、分解して考えれば、かなりの部分が水である。コーヒー、お茶そのほか生活上のほとんどのものは、水に何かが混入されたものだと思っていい。このようなとき、主となる水を溶媒、混じっている物質を溶質、その全体を溶液という。濃度の表し方は、分子の数の割合で示すモル濃度、体積比の体積濃度なども使われるが、表には重さの割合で示す重量 (wt % ) が使用されている。
水よりも密度の大きい質量が混入すれば、当然溶液濃度は増える。その増加も、下図にみるように、濃度に対してはほとんど直線 (数学的には線形とよぶ)である。
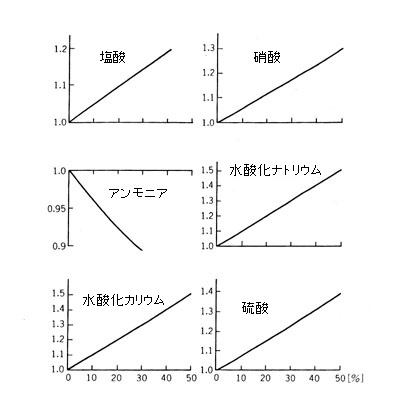
水溶液の密度
分子そのものの重さは H2O = 18 に対し
HCl = 36.5 HNO3 = 63
NH3 = 17 NaOH = 40
KOH = 46 H2SO4 = 98
であるが、横軸は重量濃度だから重い分子(例えば H2SO4 )が混ざったとしても、その分子量に比例して溶液の濃度が大きくなるとはかぎらない。
ただ、アンモニア溶液にかぎってみると、その分量比は 17/18 = 0.944 であるにもかかわらず、重量で 30 % の NH3 を含むと密度は 0.9 を割ってしまう。おそらく水中に NH3 分子が入り込むと、分子の変化(例えば NH4OH をつくったり NH4+ + OH- になったり) が生じたり、水分子の配列を乱して、かなりの隙間ができるということであろうか。
【理科年表編集委員会(2006年11月)】




