物理/化学部「粘度(粘性係数)」をくわしく解説!
液体にも気体にも「ねばっこさ」という量があり、これを粘度という。ひまし油などは粘度が大きく (ねばねばしている )、化学の実験をしたことのある人は、ビンの中のエーテルは、振ってみるときわめて激しく動くことは知られている。粘度は温度によってかなり変わるから、粘度の温度依存性は物性物理学の対象として、その理論的な裏付けが研究されている。
粘度(粘度係数ということもある)はもちろん数値を用いて表現されなければならないが、正確にはどのように定義されるべきものだろうか。
細い管を液体または気体が通るとき、管の中央部で最も速く、管壁に近い部分では遅い。流れの方向に 1 枚の板があるとすれば、板の面に図のような力 F が働くことになり、この力は速度勾配 dυ/dz ( z は管壁から中央部にかけての距離)に比例する。さらに流体の性質にも関係し、このときの係数 η でその「性質」を表すことにする。つまり
F/S = η(dυ/dz)
とおき、 η を粘度とよぶ。
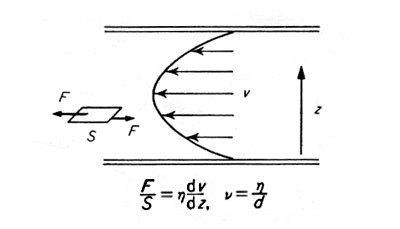
η が大きければ、管の中央部の流体の速さは遅くなり、この値が粘度である。単位は F/S つまりパスカルを dυ/dz すなわち m/s ÷ m = 1/s で割って Pa・s になる。従来は CGS 単位つまり cm-1・g・s-1 で表して、これをポアズ(記号 P)とよんでいた。
1 Pa・s = 10 P = 103cP
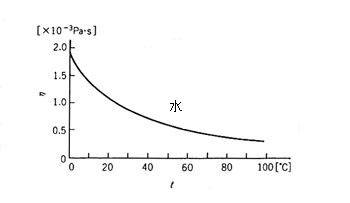
多くの液体が 10-3Pa・s = 10-2P 程度であったため、 1/100 ポアズの単位を用い、センチポアズ(cP) を使う習慣があった。水と水銀の粘度の温度依存性は図のようになる。縦軸の値は 1000 分の 1Pa・s すなわち cP である。
液体では高温ほど粘度は小さくなるが、とくに水では、沸点の 100 ℃ での値は氷点の 0 ℃ のときの 16 % しかない。わずか 100 ℃ の間で、物理的な量がこのように大幅に変化する例は珍しい。
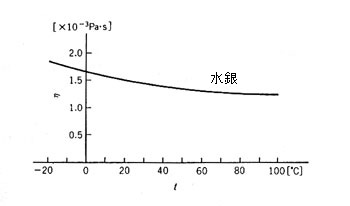
水銀の粘度の温度依存は水より小さいが、とにかく液体では高温ほど「ねばり」が小さくなる。
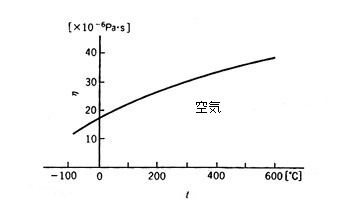
液体では温度が高いほど粘度は小さいが、気体では逆に高温ほど粘度は大きくなる。
もっとも気体の粘度は液体の 1/100 程度だが、それでも温度依存度は大きい。両者の温度による変化が逆になるのを、分子論的な立場から説明するのはいささかややこしいが、直感的に説明すると次のようになる。
液体分子は、かなり密に凝縮しており、個々の分子は狭い空間で振動している。管の両端には圧力がかかっていて、この圧力のために分子は移動する。管壁の分子は壁に邪魔されて移動困難であり、管の中央部にある分子は流れの方向によく走る。隅の遅い分子がそのまま中央部へ行ったり、中央部の速い分子が管壁の方へ行ったりして全体の流れを乱す現象が粘性なのである。
温度が上がると液体では、流れと垂直方向(図の z の方向)に動くよりも、圧力方向( 流れの方向)に移動する傾向が、いっそう強くなる。つまり「よく流れる」ようになる。だから粘度は減る。このことは直感的にも、ほぼ納得できよう。
しかし気体分子は、広い空間を飛び回っているのである。温度が上がるとその速度は大きくなる。流れに垂直方向にも、遠くまで走ってしまう。つまり遅い分子と速い分子とが、よく混じり合い、そのため粘度は大きくなってしまうのである。気体の粘度とは、あまり感覚的にピンとこないが、温度が上がると増加するものなのである。
動粘度 υ というのは、流体の密度を d としたとき r = η/d により定義される。だから η を kg/m3 で割って、単位は m2・s-1 となる。密度が大きければ、 z 方向(速度勾配への方向 )への移動も当然にぶくなるから、場合によっては η よりも υ で分子運動の乱れやすさを表した方が、適当であろう。
なお、動粘度の CGS 単位 [ cm2/s ] をストークス(St)という。 1 St = 1 Pg-1・cm3 の関係になる。
一般には、粘度の温度依存よりも、どの物質がねばっこいかを知る方が興味深いだろう。表によれば、ひまし油が断然大きく (25 ℃ で 700 × 10-3Pa・s )、硫酸、アニリンも大きい。エチルアルコール、四塩化炭素、水銀などは水とほとんど同じであり、ベンゼン、メチルアルコール、アセトン、ジエチルエーテルは小さい。
【理科年表編集委員会(2006年11月)】




