物理 / 化学部「表面張力」をくわしく解説!
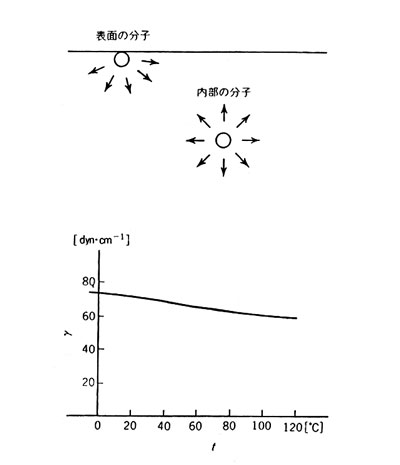
固体や液体のような凝縮系では、それらを構成する原子や分子は、互いに強い力で結ばれている。原子・分子相互間に引力があるが、どの方向からも同じ強さの力が働いているため、均衡がとれている。ところが物体の表面 (液体では液面 )にある原子 ・ 分子については話が違う。物体の内部にばかり引かれることになる。固体では、この程度の力によって形態が変わることはないが、液体の自由表面ではこの力のため、表面積をなるべく小さくしようとする。この 2 次元内の力が表面張力である。
水の表面張力
液体分子相互間には引力、すなわちマイナスの位置エネルギーがあるが、表面分子にはその一部が欠けている。したがって内部分子よりエネルギーが高く、そのエネルギーの (正確には自由エネルギーの)単位面積当たりの量
erg・cm-2 = dyn・cm-1
が表面張力になるが、式からわかるように、表面という 2 次元の面を考え、その面内に作用する単位長さ当たりの力と見なしてもいい。習慣的に MKS でなく、 CGS 単位を用いて、 dyn・cm-1 で表されている。
容器に一杯満たした水が、やや盛り上がるのは表面張力のためである。蓮の葉に落ちた水滴が、球状になるのも、水に表面張力があるせいである。しかし、これらの現象は、容器と水、葉と水との間の性質にも関係する。水は葉に対して「乾き」の性質があるため (乾きのことを正しくは接触角が鈍角という )、水は葉との接触面を小さくしようとする。そうして水自身は、自分の持つ表面張力という性質のためにまるくなる。
ガラスと水との接触角は鋭触、つまり水はガラスに対しては「濡れ」の関係にある。だから中空のガラス管を水中に入れれば、水は管の中を昇る。
水銀の表面張力はきわめて大きいが(20 ℃ で 482.1)ガラスとは乾きの関係にある。だから中空ガラス棒を水銀中に突込めば、管中の液面はぐっと下がる。しかし、水銀の密度が大きいため、つまり水銀は重いから、下がりの目盛りもそれほどには大きくならない。とにかく管中で液体が上がるのも下がるのも、その表面張力が大きく影響し、「濡れ」(液体と容器との付着力大 )なら上がり、「乾き」(付着力が液体の凝集力より小 )なら押し下げられる。
一般に表面張力は温度上昇とともに減少する。表には -5 ℃ や 120 ℃ の水の値が挙げられているが、これは大きな圧力をかけて H2O を液体状態に保って測定した値になっている。
常温で液相をなすのは多くは有機物質であるが、表面張力の値は 20 ~ 40 程度と小さい。アンモニア水 (59.3)や硫酸(55.1)も水には及ばない。
しかし、金属では原子間引力が大きいため、表面張力も大きくなる。水銀以外は高温にしなければ金属液体はできないが、金 (1120)や鉄(1720)はたとえ液化しても、原子同士はいわゆる金属結合というメカニズムのため、ガッチリと結び付いていることが推測される。
【理科年表編集委員会(2006年11月)】
|