物理 / 化学部「無機物の水に対する溶解度 暖かい海と冷たい海どちらがしょっぱいか」をくわしく解説!
われわれが通常飲料、料理、あるいは液体化学薬品など、手にすることの多い液体の多くは水溶液である。水に物質を溶かすとき、多めに混合すれば、容器の底に沈殿してしまうことはしばしば経験する。決して無限に溶け込むわけではない。いわゆる飽和水溶液となれば、それ以上は水は溶質を持ちかかえることはできない。水と物質とを合わせたもの …… 100 g 中に、どれほどの物質が溶け込んでいるかを詳しく調べたのが溶解度である。とくにその温度変化が注目される。
下図は、無機物の水に対する溶解度が、温度に対してどのように変化するかを示している。塩化ナトリウム (NaCl)は、ほとんど温度に依存しない(「拡散」の場合には、溶けていく速さを問題にするのに対して、ここではその温度でどれだけの量が溶けるかを調べているのであるから、両者を混同してはならない )。暖かい海水も、冷たい海水も、同じようにしょっぱいわけである。
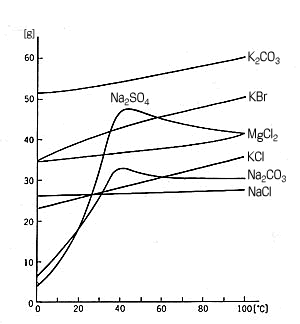
無機物の水に対する溶解度
塩化カリウム(KCl)、塩化マグネシウム( MgCl2 )、炭酸カリウム (K2CO3 ) はほぼ同じ程度に、温度上昇とともに溶解度は大きくなっている。化学的に類似な NaCl と KCl が、後者だけが温度依存性のあることは、液体分子論の立場から研究されてよかろう。
とくに顕著なのは、炭酸ナトリウム (Na2CO3 ) と硫酸ナトリウム ( Na2SO4 ) である。 0 ℃ ではほとんど溶けないが、 40 ℃ 近辺で非常によく溶解し、それ以上の温度では溶解度は横ばいか、多少減りぎみになっている。これらは単なる物理的混合 (その分子のまま、あるいはイオンに分かれて、そのイオンのまま水中に入ること )ではなく、水分子と複雑な化学反応をするため、溶解度曲線が特異になると考えられる。実際炭素ナトリウムは、一、七、十水和物をつくり、たとえば [Na2(OH)10]2+ と CO32- になったりする。硫酸ナトリウムも 32.4 ℃ 以下で十水和物を形成する。
それではナトリウム化合物の溶解度は、常に一定温度で最大になるかというと、必ずしもそうではない。 3 種類のリン酸ナトリウム NaH2PO4 、 Na2HPO4 、 Na3PO4 はいずれも高温ほどよく溶ける。むしろ硫酸マグネシウム (MgSO4)の溶解度が 80 ℃ 近辺で最大になるようである。
【理科年表編集委員会(2006年11月)】




