物理 / 化学部「有機物の水に対する溶解度 砂糖は熱いコーヒーによく溶ける」をくわしく解説!
有機物の水に対する溶解度
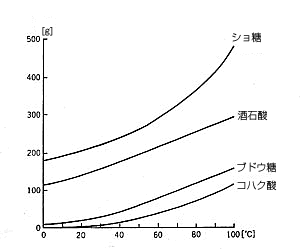
有機物の水に対する溶解度は、無機物に比べて温度依存性が大きい。最も特徴的なのはショ糖であり、高温ではきわめてよく溶ける。熱いコーヒーには砂糖がよく溶けるのは多くの人が経験している。
よく溶けるといっても、有機物は構造が複雑で 1 つの分子が重いため、例えばグラフに並べた有機物では、コハク酸(CH2CO2H)2、酒石酸(ただし右旋性のもの)(CHOH・CO2H)2、ブドウ糖(dl)C6H12O6、ショ糖 C12H22O11 の順に分子量は大きくなる。対して、無機物である食塩 NaCl の分子量は 58.5 だから、砂糖の主成分であるショ糖の 342 と比べると6分の1弱になる。つまり、同じ分子数(あるいはモル数)に換算すれば、NaClが 10 g 溶けることはショ糖が 60 g 溶けることに相当し、塩に比べて砂糖はよく溶けるといえよう。とくに 100 ℃ では 0 ℃ のときよりも 2.7 倍も溶解するのである。
ブドウ糖、コハク酸はもちろん、酒石酸(右旋性 )も 0 ℃ では、分子の個数で考えると、決して溶けやすいとはいえない。ところが高温の水 (つまり湯)にはよく溶ける。
水分子 (H2O) は低温では、その O と O とが H をなかだちとして O-H … O のようにつながり、結晶に似た機構をしている。これを水素結合というが、温度上昇とともに水素結合はどんどん切断されていくと考えられている。 H2O 分子が単独に動けるようになったり、 (H3O)+ 、 (HO)- に相当するものが水の中にできてくる。無機物ではこれらと化学的に結びつくことは少ないから、ただ水分子の間に入り込むだけである。ところが有機物では破壊された水の結晶 (?)の一部と結合しやすい。有機分子自身がまた水素結合をもっていることが多い。とにかくこのようなわけで、高温度の水と有機物分子は相性がよく、よく溶解するものと思われる。ピクリン酸 C6H2(NO2)3OH はきわめて溶解度が小さいが、それでも 100 ℃ では 0 ℃ の場合の 10 倍強も溶けるのである。
【理科年表編集委員会(2006年11月)】




