物理 / 化学部「気体の水に対する溶解度」をくわしく解説!
水に固体や液体を混入すれば、飽和になるまで溶けるが、水は自由表面で気体と接触しているのがふつうである。この気体も、わずかであるが水に溶けているのである。溶解している気体の量をいい表すには、 1 cm3 の水に溶け込んでいる気体を、仮に取り出すことができるとして、その気体が 1 気圧のもとで何 cm3 の体積を占めるかの数値をいう。気体の体積は分子数 (あるいはモル数)に比例するから、原子量・ 分子量に関係なく、気体の溶解度は溶け込んでいる分子数に比例すると考えていい。
もちろん液体の自由表面に接している気体の圧力を倍にすれば、気体の溶解度も倍になる。だから平衡気圧の圧力を 1 気圧と決めておかなければならない。
気体分子は、水と化学反応をするアンモニア(NH3 )などは、途方もなく大量に溶け込んでしまう(0 ℃ で 1176 cm3 相当 )。また塩化水素 (HCl)も溶けやすい。濃塩酸や希塩酸などは、しばしば化学薬品として登場する。二酸化硫黄 (いわゆる亜硫酸ガス SO2 ) や硫化水素(H2S)もよく溶ける。原子 S は原子 O と化学的に類似しており、水 H2O とは化学的にも結び付きやすいためであろう。
二酸化炭素(CO2 ) もかなり溶けやすいが、他の気体、一酸化窒素(NO )、酸素(O2 ) 、一酸化炭素 (CO)、空気はいずれも似たような性質を示す。当然窒素 (N2 ) は空気より溶けにくい (酸素の方が溶けやすいから)。
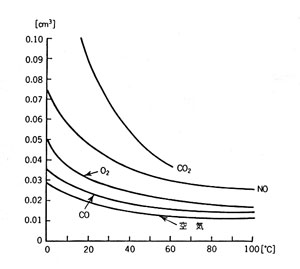
気体の水に対する溶解度
溶解度の温度依存で、固体・液体と異なるのは、高温ほど溶けにくいことである。この特徴は次のように説明される。
固体や液体を形成している原子 ・ 分子は、もともと他の原子 ・ 分子とよく結び付き、大きな物質(液体をも含めて )をつくるのにふさわしいものである。そのため水中に潜り込んでも、何らかの意味で水分子とくっつきやすい。高温ならば水の水素結合が壊され、その分だけ他分子と結び付く可能性が大きくなる。
ところが N2 、 C2 、 CO2 などの気体分子は、他分子とほとんど結合しない。だからきわめて低温度にならなければ、これらの物質は凝縮系 (液体さらに固体)にならない。
このような気体分子が水中にあっても、水分子との間の引力はきわめて小さい。金属中の自由電子や、容器中の液体と同じで、水面から容器の縁までのエネルギー(金属の場合には、このエネルギーを仕事関数という )さえ獲得すれば外に飛び出してしまう。
溶液が熱くなるということは、中の気体分子の運動エネルギーが大きくなることを意味する。粒子が高さ U(活性化エネルギーに相当するもの)の壁を越える確率は
exp(-U/kT)
に比例する。 k はボルツマン定数であり、 1 モルの場合には気体定数 R になる。つまり系の温度が T(もちろん絶対温度)のとき、溶液中に存在しない確率がこの因子で表され、実験曲線はよくこの事情を説明している。
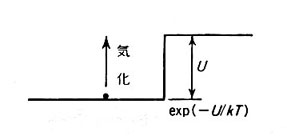
気化の確率
要は、水中の気体分子は、温度が上昇すると活発に動く結果、溶液から出ていくことが多く、このため高温での気体の溶解度が減ると考えるのが当を得ていよう。
【理科年表編集委員会(2006年11月)】




