20世紀後半,爆発的に進展した生命科学の中心テーマは,セントラルドグマすなわち“遺伝子からタンパク質合成に至る研究”に集約されるように「タンパク質の生の生物学」であった.一方,今日「タンパク質分解,すなわちタンパク質の死の生物学」の研究の飛躍的な発展から“タンパク質の死は生と同様に非常に重要である”との考え方が生命科学の隅々に定着しつつある.このタンパク質分解を触媒する分子がタンパク質分解酵素であり,生体内には数百にも及ぶタンパク質分解酵素が存在する.しかしこの新しい概念が提案されるに至った原動力は,ユビキチン(タンパク質の分解シグナル分子)とプロテアソーム(真核生物のATP依存性プロテアーゼ)の発見であった.ユビキチン・プロテアソームシステム(UPS)は選択的なタンパク質分解を担う細胞内装置であり,多様な生体反応を迅速に,順序よく,一過的にかつ一方向に決定する合理的な手段として細胞周期・アポトーシス・代謝調節・免疫応答・シグナル伝達・転写制御・品質管理・ストレス応答・DNA修復など生命科学の様々な領域で中心的な役割を果たしている.その象徴的な出来事としては2004年ノーベル化学賞が「ユビキチンの媒介するタンパク質分解の発見」のテーマに授与されたことが挙げられる.ユビキチンは76個のアミノ酸からなる小さなタンパク質であり,すべての真核生物に普遍的に存在しているが,原核生物には存在しない.ユビキチンは活性化酵素(E1)・結合酵素(E2)・リガーゼ(E3)から構成された複合酵素系によって標的タンパク質に共有結合するモディファイヤーである.そしてユビキチン分子間での縮合反応を繰り返すことによって,多数のユビキチンが鎖状に伸長したポリユビキチン鎖が形成されると,これが26Sプロテアソームの分解目印となり基質タンパク質は分解される.26Sプロテアソームは触媒ユニットである20Sプロテアソームの両端に調節ユニットであるPA700が会合した分子量250万,総サブユニット数約100個から構成された巨大で複雑な分子複合体である.20Sプロテアソームはトリプシン様,キモトリプシン様,カスパーゼ様の活性を有した多機能型のスレオニンプロテアーゼである.プロテアソームには免疫応答に関与する免疫プロテアソームやハイブリッドプロテアソームなど分子多様性が存在する.UPSによるタンパク質の分解は細胞の分化や増殖の制御,恒常性維持に必須な役割を担っており,最近その破綻による疾病が急増している.したがってUPSの研究は,人間の健康を守る科学に大きく成長する可能性を持っている.
【 田中啓二 】
|
■トピックス後日談■
「タンパク質リサイクルシステム ~注目されるオートファジー~」
細胞内には,二つの大規模なタンパク質分解システムが存在する.オートファジー・リソソームシステム(ALS:autophagy-lysosome system)とユビキチン・プロテアソームシステム(UPS:ubiquitin-proteasome system)である(図1).UPSは,ユビキチン(分解シグナルを付与する翻訳後修飾分子)による標的基質の選別とプロテアソーム(ATP依存性タンパク質分解酵素)による標的基質の破壊の二つのプロセスから構成されており,選択的タンパク質分解の主役を担っている.UPSについては,『理科年表』(2005年)において,その発見から基本的概念の確立に至る経緯を解説したので,後日談としてALSについて史的背景を見据えながら考察する.その理由は,我が国の大隅良典栄誉教授(東京工業大学)が「オートファジー機構の解明」により,2016年,ノーベル生理学医学賞を受賞したからである.この金字塔に象徴されるようにオートファジー研究は近年目覚ましい発展を遂げてきた.ALS研究の黎明期の1955年,C de Duveは多様な加水分解酵素を含む細胞内小器官(オルガネラ)を発見してリソソーム(リソ:溶解,ソーム:顆粒)と命名,この発見によって1974年にノーベル生理学医学賞を受賞した.リソソームはカテプシンと呼ばれる一群のタンパク質分解酵素を含んでいることから,細胞内におけるタンパク質分解の場として働き,言わば焼却炉としてタンパク質をアミノ酸にまで完全分解することができる.と同時にde Duveは,1963年に細胞が自身のタンパク質を小胞(オートファゴソーム)として隔離した後,リソソームと融合して分解する現象を発見し,オートファジー(自食作用と訳出)と命名した(図2上パネル).しかし当時,オートファゴソームを検出する手段としては,電子顕微鏡による観察しかなかったために,20世紀後半に爆発的に発展した最先端の分子生物学的技術の恩恵を受けることがなく,オートファジー研究は,発見後30年間,遅々として進展しなかった.しかしこの長く続いた閉塞状況は,一研究者の叡智によって突然に打破された.すなわち1993年,大隅教授が約15種のオートファジー遺伝子(ATG:autophagy related gene)を発見すると,オートファジー研究はそれまでの停滞が完全に払拭され,その後今日に至るまで未曾有の成長を遂げてきたのである.実際,オートファジーの論文は,ATG遺伝子群発見以前には,年間10編前後であったが,ATG遺伝子群発見後の2016年には約5000編と騎虎の勢いで拡大している.このオートファジー遺伝子群の発見という卓越した業績により,大隅教授は2016年度のノーベル生理学医学賞を単独で受賞するという至高の栄誉に輝いた.さてALSは,上述したように小胞形成を経由した分解様式から非選択的なタンパク質分解系と考えられていたが,ごく最近,複数のオートファジー受容体が発見され,それらが仲介する選択的なタンパク質分解系の存在が明確となり,その重要性についても大きな注目を浴びている(図2下パネル・図3).オートファジーは,酵母からヒトに至るまで真核生物に見られる普遍的な現象であり,飢餓ストレスにさらされると激しく誘導されるなど,栄養素確保に向けた生存の究極的な手段であるが,同時に細胞内に蓄積した異常タンパク質・損傷オルガネラや細胞質内に侵入した病原微生物を選別して排除することで生体の恒常性を維持する役割も担っている.またオートファジーは,個体発生や神経変性疾患の発症阻止,がん化抑制などにも関与することが知られており,その病態生理学的研究は,拡大の一途をたどっている.以上,ALSについてその概略を記載したが,現在,UPSの研究も飛躍的に進展しており,これら二つの細胞内タンパク質分解系は,生命科学において基礎研究のみでなくヒトの健康を守るための医学研究としても,その重要性を謳歌している.
【 田中啓二(2017年8月) 】
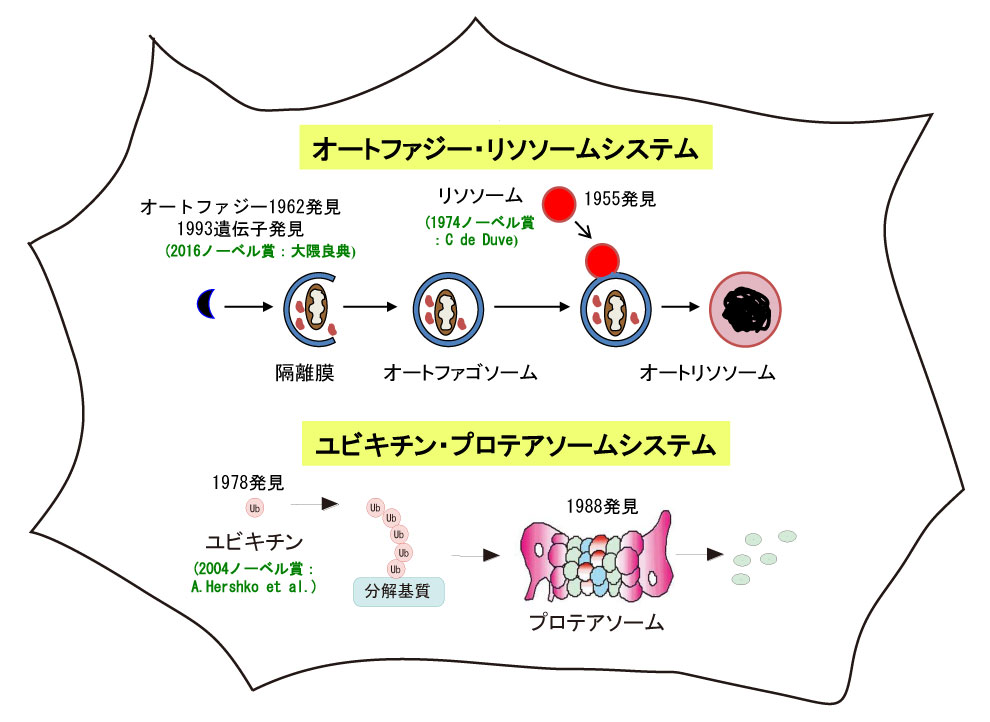
図1 真核生物の二つの大規模なタンパク質分解システム.
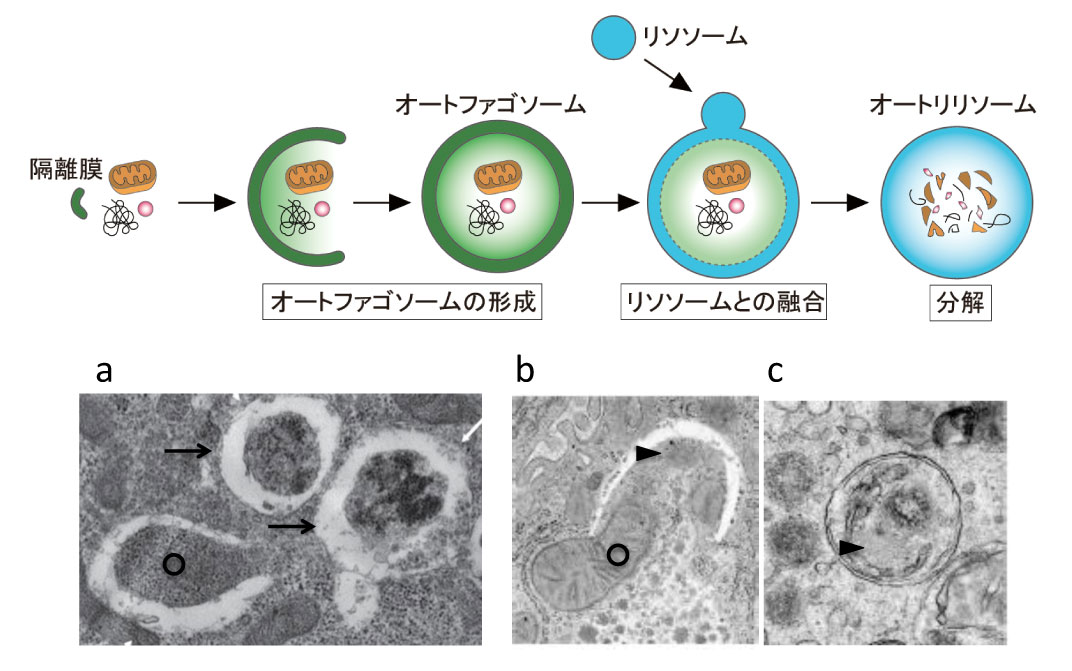
図2 オートファジー・リソソーム経路の模式図(上)とオートファジーの電子顕微鏡観察(下).上図:本文参照.下図:(a)栄養飢餓に応答した非選択分解.初代培養肝細胞からアミノ酸を除去した後の電子顕微鏡写真.丸印:オートファゴソーム形成途中.矢印:オートリソソーム(オートファゴソームにリソソームが融合して隔離した細胞質成分を無差別に分解している).(b,c)プロテアソームを遺伝学的に欠失させたマウス肝臓の電子顕微鏡写真.異常タンパク質凝集体(arrow head)や損傷ミトコンドリア(丸印)が選択的に隔離幕で取り囲まれる様子(b)や異常タンパク質凝集体(arrow head)を取り込んだオートファゴソーム(c).
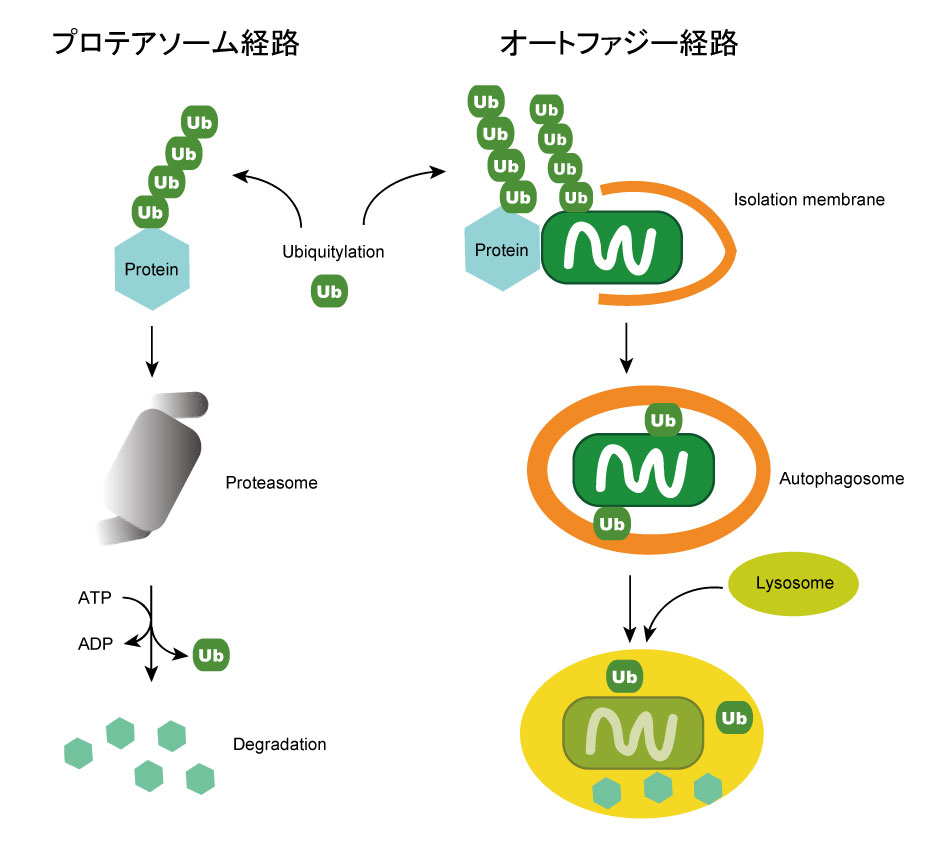
図3 細胞内の選択的タンパク質分解経路の模式図.Ub:ユビキチン.ユビキチンは不必要な基質タンパク質に鎖状に結合すると,プロテアソームやオートファジーの分解シグナルとして機能する.オートファジーは,ユビキチンで修飾された損傷ミトコンドリアなどのオルガネラも選択的に分解できる.
|







