創薬の最前線
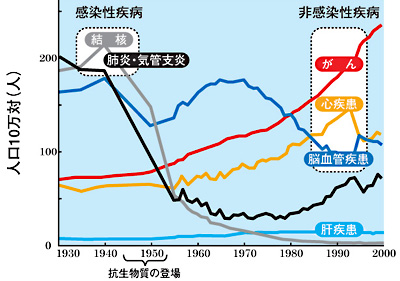
現代の創薬基盤は、20 世紀初めの抗生物質の発見にさかのぼることができます。抗生物質は、様々な伝染病の原因となる病原菌には毒ですが、人体には無害であるという、「選択毒性」を基盤にした薬です。抗生物質の誕生により、結核など多くの伝染性・感染性の病気が克服されてきました。その後、選択毒性の概念は、生物種の間の選択性から、生体内の組織や細胞の種類、さらには生体内の分子それぞれの間での選択性へと演繹され、さらに「毒性」についても、単なる機能阻害から機能の制御へと概念が演繹されて現在に至っています。
現在では、薬の多くは生体内の特定の分子に結合して作用を発揮することが解っています。そのような分子は「薬物受容体」と呼ばれます。したがって、創薬においては、第一に、いかなる分子を薬物受容体に設定するか、第二に、設定した薬物受容体に結合してその機能を制御する化合物をいかに効率的に創製するか、がポイントです。
薬物受容体の設定方法については、「ゲノム創薬」や「分子標的創薬」と呼ばれる手法が話題になっています。ゲノム創薬の基本的な流れは以下のとおりです。まず、正常な状態と病気の状態を、遺伝子やその発現のレベルで比較し、当該の病気に関連する遺伝子を同定します。次いで、同定した遺伝子の産物 (タンパク質)の機能を調べたうえでこれを薬物受容体に設定します。その薬物受容体が当該の病気において増悪因子であればその機能を阻害する化合物を、逆に病気の抑制因子であればその機能を亢進する化合物を薬として創製しようとします。分子標的創薬では、例えば、がんを例にとると、がん細胞で特異的あるいは選択的に発現している分子を薬物受容体に設定します。こうした薬物受容体の設定方法に基づけば、これまで問題となっていた副作用を大きく軽減できると考えられます。ただし、こうした薬物受容体の設定方法は、当該の病気が特定のタンパク質の異常という、いってみれば部品の異常に基づく病気であれば大いに有効ですが、そうではなく、注目する病気が、多数の要因が関与するシステムの異常に基づくものである場合には期待するほどには有効でないと考えられ、今後の課題です。
いったん薬物受容体が設定されると、次はそれに作用する化合物をいかに効率的に創製すかが第二のポイントです。これについては、「コンピュータ分子設計」、「ハイスループットスクリーニング (HTS)」、「コンビナトリアルケミストリー」といった手法が話題になっています。コンピュータ分子設計とは、基本的には薬物受容体の構造を鋳型として、それにぴったりとはまる化合物をコンピュータ計算の助けを借りて探索する手法で、「バーチャルスクリーニング」とも呼ばれます。 HTS は、膨大な数の化合物群(ケミカルライブラリーといいます )を、ロボット工学の力を借りて片っ端からその機能を検定する手法で、短期間に数千・数万の化合物の活性を評価して活性化合物を発見しようとするものです。そのためには構造的に多種多様な化合物群が必要です。そのような化合物群を、いろいろな構造単位を組み合わせて一気に創製する手法がコンビナトリアルケミストリーと呼ばれる技術です。
【橋本祐一 東京大学分子細胞生物学研究所(2008年 7月)】


.jpg)