物理 / 化学部「原子量」をくわしく解説!
ある物質は密度(あるいは比重 )が大きく、ある物質は小さい。同じ固体でありながらどうして違うのだろうか? そのおもな理由は物質を構成する 1 つ 1 つの原子の重さが違うためである。原子の重さ (正確には質量)をいちいち SI 系で表示するものは (あまりにも小さな値になりすぎて )、決して得策ではない、というわけで原子量という考え方が導入された。歴史的には最初に、最も軽い水素原子を 1 としたが、その後化学の発達とともに、酸素化合物が多く問題になり、基礎の原子を酸素にとり、これを 16 とした。
しかしどうしたわけか、物理学と化学では定義が異なっていた。物理学では核子 (陽子と中性子)の和が 16 の 16O の重さを 16 としたのに対して化学では天然の酸素 (当然 17O と 18O とがわずかに混合している)の重さを 16 と決めた。だから物理と化学とでアボガドロ数も食い違い、この状態が第二次世界大戦後まで長く続いたのである。
原子量が精密に測定されるのに及んで、この不便さがいっそう浮彫りにされ、結局 12C の質量を 12 と決めることになった。そうして 1985 年に国際純正 ・ 応用化学連合の原子量委員会により、適正な原子量の値が勧告されたのである。核子の数は整数(これを質量数と呼び A で表す)だから原子量も整数あるいはかぎりなく整数に近い数値であるはずだが、その中途の数 (塩素 Cl は 35.453)になっているのは同位体のせいである。塩素では 35Cl が約 76 % 、37Cl が 24 % 存在するために、平均値が 35.453 になってしまう。マグネシウム (Mg)の 24.3050 や銅(Cu)の 63.546 あるいは亜鉛 (Zn)の 65.3409 などは安定同位体の多いことを物語っている。
原子量が半端な数になるのは、もう 1 つ理由がある。たとえばヘリウムの原子量 (4.002602)は水素(1.00794)の 4 倍よりやや少ない。ただしヘリウムの電子の数は水素の 2 倍だから、そのぶんだけ(水素の 4 倍より) 小さいわけだが、中性子は陽子よりやや重く、陽子 2 つと中性子 2 つのヘリウムは、計算上は水素の 4 倍よりは少しだけ重くなるはずである。それなのに、実際は軽くなっているのはなぜか?
ヘリウムの核子(陽子と中性子)はきわめて固く結ばれているのである。固く結ばれるということは、位置エネルギーが深い(マイナスで絶対値が大きい )ことを意味する。エネルギー E と質量 m とはアインシュタインの相対論の式 E = mc2 (ただし c は光速度)で関係づけられ、早くいえば両者は同じものである。小さな質量は、巨大なエネルギーに該当する。逆にエネルギーが深い (例えばヘリウム原子核のように) ときには、その分だけ軽くなるのである。原子核の重さがこのように陽子の中性子の重さの単純な和にならない現象を、質量欠損とよぶ。ただし質量欠損によって原子量が半端になる割合は、同位元素に原因する場合よりもはるかに小さい。
ヘリウム原子核は質量欠損のため軽く、エネルギーが低いから安定である。原子核が陽子 1 個、中性子 1 個からできている原子を重水素というが、重水素が 2 つ結合するとヘリウムになる。このとき位置エネルギーはかなり減る。エネルギー保存則から運動エネルギーは増加する。その増加の程度がきわめて大きいから、付近の重水素も揺り動かし、連鎖反応をする。これを核融合とよび、瞬間的に膨大なエネルギーを放出するのが水素爆弾である。このほか核融合は、リチウム原子核 (陽子 3 個、中性子 4 個)と水素原子を結合させてヘリウム 2 個を生ずる反応なども考えられている。
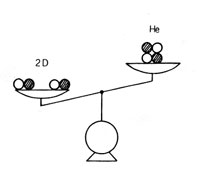 |
重水素 2 つの方がヘリウムよりも質量が大きい。 この差(質量欠損)のために核融合が起こる。 |
一方ウランの同位体の 235U は不安定で(ということはこわれやすく )、ほとんどまっぷたつに分かれて、質量欠損の大きい 2 つの原子核になろうとする傾向がある。これが核分裂であり、瞬間的にこの現象が生じると原子爆弾になる。
核分裂と核融合は反対の現象であるが、いずれも質量欠損の大きな原子に連鎖的に移行しようとする現象のことである。
【理科年表編集委員会(2006年11月)】




