エピゲノム 2013年版(平成25年版)
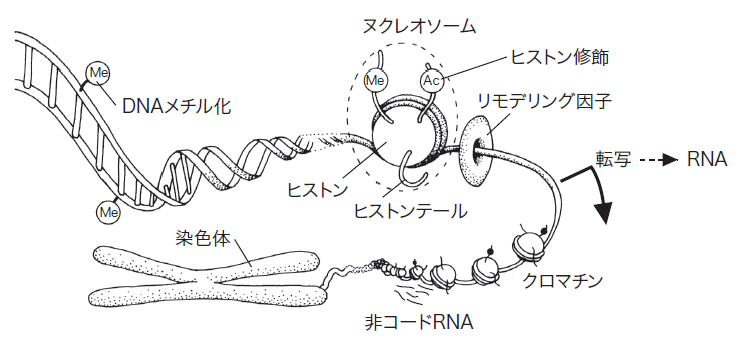
ヒトをはじめとする多細胞生物の個体を構成する細胞のゲノムは基本的に同一であるものの、1 つの受精卵から肝臓、神経、筋肉というように異なる働きをする細胞が形成される。肝細胞は分裂しても肝細胞であり、細胞ごとの特徴を規定している 「 細胞の記憶 」 がエピゲノム情報である。近年では終末分化した細胞から多分化能を有する iPS 細胞へとリプロプラミングすることも可能となり、その過程ではエピゲノムが書き換えられている。
遺伝物質である DNA が細胞核内でヒストンタンパクに巻き付く形で構成されるヌクレオソームがクロマチンの基本的構成単位である。エピゲノム修飾には DNA 自身のメチル化やヒストンのメチル化、アセチル化、リン酸化、ユビキチン化などのさまざまな化学修飾が存在し、染色体 DNA からの情報読み出しの制御を行う。すなわち、エピゲノム情報は細胞系譜ごとにユニークであり、化学修飾による標識を付加することにより、細胞ごとに異なる遺伝子群を利用あるいは不活化する。
従来、クロマチン免疫沈降(ヒストン修飾や転写因子結合などのタンパク質 DNA 相互作用) 、バイサルファイト処理(DNA メチル化)、DNA 免疫沈降(DNA メチル化) 、DNase1 処理(開存したクロマチン)などさまざまな分子生物学的手法で特定のゲノム領域のエピジェネティックな標識が解析されてきた。次世代シーケンサー技術の最近の進歩により大量の DNA 配列を取得可能となったことにより、修飾が存在するゲノム領域の DNA を濃縮、回収、配列決定することにより、網羅的にエピゲノム解析を行うことが可能となった。
さらに、DNA から転写される RNA も次世代シーケンサーにより配列決定することが可能となり、バリアントを含めた転写産物の全貌が明らかになりつつある。RNA の中にはタンパク質へと翻訳されるメッセンジャー RNA のほかに、マイクロ RNA を含む非コード RNA が存在することが知られる。非コード RNA が転写因子タンパクと結合して特定のゲノム領域に複合体をリクルートすることも知られつつあり、エピゲノム修飾の形成に重要な役割を果たしている。
近年、米国の ENCODE(Encyclopedia of DNA Elements)プロジェクトや国際エピゲノムコンソーシウムでエピゲノム情報が系統的に取得されており、エピゲノム標識による生命現象制御の仕組みの理解が深まりつつある。
【油谷浩幸】




