エピジェネティクス研究の最前線 2009年版(平成21年版)
生物の設計図ゲノムの全塩基配列が決定されたが,ヒトを含む多細胞生物の生命活動はゲノム塩基配列という1次情報からだけでは理解できない.同じゲノムを持ちながら,どのようにして,(1)細胞の種類に特有の遺伝子(群)のみが発現し,他の遺伝子(群)は発現しないのか? また,(2)(1)の遺伝子(群)の発現する・しないは細胞分裂後も維持され得るのか? これらは1次情報のみからは分からないからである.エピジェネティクス(epigenetics)とは「DNAの塩基配列の変化を伴わずに細胞分裂後も伝達される遺伝子機能の変化について探求する学問領域」を意味する.
哺乳類のDNA二重らせんは約2mにもなるが,DNA結合タンパク質(ヒストンと非ヒストンタンパク質)に結合し,きちんと整頓されクロマチンとなり直径が数μmの核に収納されている.哺乳類ではDNAを構成するアデニン(A),グアニン(G),シトシン(C),チミン(T)の4種類の塩基のうち,おもにCG配列のCがメチル化される(図1a.植物などではCG配列に加え,CNG,そしてCNNもメチル化される.NはG以外の塩基).DNAメチル化パターンはDNAメチル化酵素により塩基配列と同様に細胞分裂後も継承され得る.DNAがメチル化された領域はヒストン修飾(アセチル化やメチル化など)が変化してクロマチン構造が凝縮し(図1b),たとえ転写因子が存在しても遺伝子は転写できず休眠状態となる(図1c).また,クロマチンが凝縮しているためゲノムの安定性が増すことになる.
このようにDNAメチル化とヒストン修飾がエピジェネティクス制御の中心である(図1).メチル化されたシトシン(5-メチルシトシン)がウシ胸腺から発見されたのは1948年で,半世紀を経て大腸菌から植物,動物まで広範な生物種で発見されている(出芽酵母や線虫ではDNAメチル化は見つかっていない).
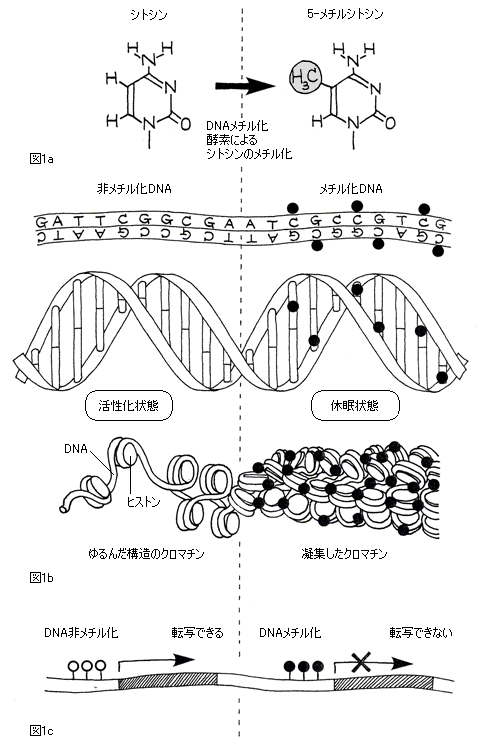
図1 DNAメチル化とさまざまなヒストン修飾が組み合わさり遺伝子が休止状態になる.発生や分化の過程で細胞の種類ごとに休眠状態と活動状態の遺伝子の組み合わせができ上がる.休眠状態は細胞分裂後も続くメカニズムがあるため,遺伝子機能の安定した制御装置になっている.
DNAメチル化は,動き回る遺伝子であるトランスポゾンの活動抑制,哺乳類のメス動物の2つあるX染色体の片方のX染色体の不活性化,親の性に依存した遺伝子の抑制であるゲノミックインプリンティング,および,組織特異的な遺伝子発現など,様々な生命現象に関わっている.ゲノミックインプリンティングに関わる遺伝子とは,父親と母親のどちらから受け継いだかによって発現が異なる遺伝子である.哺乳類の体細胞は2倍体細胞で,1組は父親から,もう1組は母親から受け継いでいる.多くは両方の遺伝子が発現するが,ゲノムインプリンティング遺伝子は片方の遺伝子しか発現しない.その他に哺乳類のゲノム上には膨大な数のメチル化領域と非メチル化領域が存在しており,細胞の種類に特有のメチル化・非メチル化模様(DNAメチル化プロフィール)ができ上がる.1個の受精卵から数百種類の体細胞が作られ,逆に,胎生期に体細胞から生殖細胞が作られる時,大幅なDNAメチル化プロフィールの書き換えがおき,DNAの折り畳まれ方も細胞の種類により異なってくるのである.
DNAメチル化とヒストン修飾のゲノム全体の情報をエピゲノム(epigenome)と呼ぶ.エピゲノムこそが細胞の種類によって異なる発現遺伝子のレパートリーの安定したメカニズムなのである.エピジェネティクスは個体発生や細胞分化の基礎であるばかりでなく,再生医療の調整や評価,および,がんを含む慢性疾患の治療法開発への新たな取り組みとして期待されている.エピゲノム解析技術も進み,国際的なエピゲノム・プロジェクトの必要性が唱えられている.
【 塩田邦郎 】
|
■トピックス後日談■ 「ヒストン多様性が生むエピジェネティクス」 【 塩田邦郎(2017年3月) 】 |




